近日,上海交通大学医学院附属第九医院教授范先群团队在开发肿瘤纳米诊疗试剂研究中首次发现,不同浓度纳米材料介导的活性氧自由基(ROS)对葡萄膜黑色素瘤(UM)细胞的恶性生长能力影响不同,一定量的ROS可激活UM细胞mTOR信号通路,增强氨基酸代谢。该研究成果发表于《尖端科学》。
ROS主要为细胞代谢所产生的副产物(例如超氧阴离子、H2O2、羟自由基、羟离子等)。正常情况下,细胞内的抗氧化系统可有效清除ROS,而当细胞内产生的ROS过量、超过细胞抗氧化系统的清除能力极限时,便会产生氧化应激反应,过氧化细胞内生物大分子,从而损伤细胞。由于肿瘤细胞代谢旺盛,因此ROS在诸多类型的肿瘤中显著上升。为此,大量研究利用纳米材料调控肿瘤细胞内产生过量的ROS杀伤肿瘤。然而,ROS亦可作为诱导或信号分子在肿瘤形成、恶性转化、化疗耐药中发挥重要作用。纳米材料诱导产生的ROS是否会对肿瘤发生发展产生未知影响,这一关键问题的解答对于应用纳米材料诊疗肿瘤具有重要的意义。
UM是成人最常见的眼内恶性肿瘤,恶性程度高,易转移,预后差,严重威胁患者视力和生命安全。相较于其他正常细胞,黑色素细胞更易受ROS的调控影响而增加黑色素瘤的发生风险。若利用纳米材料介导的ROS技术早期检测或协同治疗UM,就存在促进肿瘤发生发展的风险。
因此,研究人员利用不同浓度的碳点纳米材料诱导UM细胞产生不同水平的ROS,全面分析其是否能对肿瘤细胞发生发展产生不同作用,并基于肿瘤代谢角度阐述了这一现象背后的机制。
该论文共同第一作者丁伊介绍说,研究人员结合ROS荧光显示技术及细胞内氧化还原状态检测技术分析了UM细胞在接受碳点(C-dots)短期刺激后胞内ROS水平、抗氧化能力和细胞表型变化,结果表明不同浓度C-dots处理的UM细胞抗氧化能力截然不同,低剂量(25~100微克/毫升)的C-dots可增强UM细胞内ROS水平,同时细胞抗氧化能力增强,氧化还原水平得到再平衡,UM细胞增殖、迁移、侵袭、体外成瘤能力增强,在加入抗氧化剂NAC或Toc以消除ROS的影响后,C-dots的促进作用消失,而高剂量(200微克/毫升)C-dots产生的ROS由于打破细胞的氧化还原平衡,导致UM细胞凋亡,该结果在斑马鱼移植瘤模型及眼内原位荷瘤小鼠模型中都得到相同验证结果。
为了探索这一现象背后的机制,研究团队应用非靶向代谢组学技术联合谷氨酰胺代谢相关基因mRNA表达图谱发现C-dots诱导的ROS通过激活Akt/mTOR通路,促进谷氨酰胺代谢,加速谷氨酰胺水解成谷氨酸,为谷胱甘肽的合成提供原料,从而调控细胞氧化还原平衡。同时,谷氨酸可进一步经转氨酶作用生成α—酮戊二酸,进入三羧酸循环生成更多三磷腺苷,从而促进肿瘤细胞生长。
专家表示,该研究对于纳米材料肿瘤诊断和治疗应用中安全浓度的合理选择具有重要参考价值。(黄辛)
 全球观察:端午节期间日均132.1万人次出入境 较去年增长约2.3倍 据国家移民管理局25日消息,2023年端午节期间全国边检机关共查验出入境
全球观察:端午节期间日均132.1万人次出入境 较去年增长约2.3倍 据国家移民管理局25日消息,2023年端午节期间全国边检机关共查验出入境
 汽车博主发表贬损极狐汽车言论 极狐要求永久删除 近日,北汽极狐公司针对知名汽车博主袁启聪在抖音和微博发布的涉及极狐
汽车博主发表贬损极狐汽车言论 极狐要求永久删除 近日,北汽极狐公司针对知名汽车博主袁启聪在抖音和微博发布的涉及极狐  天天视点!极限 极限有高有低……心理极限极高的人可能身体会先到极限而出问题。身体极
天天视点!极限 极限有高有低……心理极限极高的人可能身体会先到极限而出问题。身体极  世界热推荐:观众齐喊“开空调”!梁静茹沈阳演唱会遭遇尴尬一幕 近期高温预警,再加上演出现场人员爆满,昨天是满场,估计昨天观看演唱
世界热推荐:观众齐喊“开空调”!梁静茹沈阳演唱会遭遇尴尬一幕 近期高温预警,再加上演出现场人员爆满,昨天是满场,估计昨天观看演唱 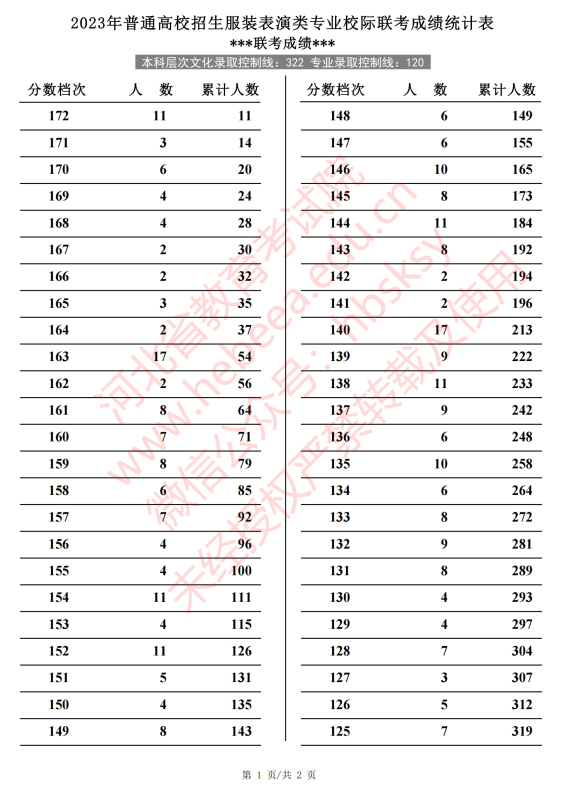 每日快看:2023年河北省普通高校招生服装表演类专业校际联考成绩统计表(专业成绩·综合成绩) 最新高考资讯、高考政策、考前准备、志愿填报、录取分数线等高考时间线
每日快看:2023年河北省普通高校招生服装表演类专业校际联考成绩统计表(专业成绩·综合成绩) 最新高考资讯、高考政策、考前准备、志愿填报、录取分数线等高考时间线  海口江东新区将建香港玉玲珑珠宝产业园 近日,记者从海口江东新区管理局获悉,位于海口江东新区离岸创新创业组
海口江东新区将建香港玉玲珑珠宝产业园 近日,记者从海口江东新区管理局获悉,位于海口江东新区离岸创新创业组