近日,中科院大连化学物理研究所研究员刘宇团队、朴海龙团队与山东大学教授刘晓静合作,通过系统性研究晶体诱导荧光分子结构与荧光之间的构效关系,实现了活细胞内无定型聚集态蛋白质组的靶向识别,为进一步发展此类探针提供了理性设计和改造方案。相关研究成果发表于《德国应用化学》。
蛋白质的错误折叠、变性与聚集可引发多种蛋白质构型疾病,如阿尔茨海默病、帕金森病、渐冻人症等。聚集的相变蛋白质根据其形貌和生化特征又可分为淀粉样聚集态和无定形聚集态。目前发展的探针大多针对胞外具有特定结构的淀粉样聚集态,而胞内无定形聚集态蛋白质缺乏清晰的结构信息,极大增加了此类探针分子的设计难度。因此,理性设计能够在活细胞内选择性识别无定形聚集态蛋白质的探针分子,对疾病的早期诊断和治疗具有积极意义。
合作团队在前期相变蛋白质探针研究基础上,从晶体聚集诱导发光骨架二氰基异佛尔酮(DCI)出发,系统性研究了分子结构与荧光之间的构效关系,理性调控探针分子的环境敏感度、结合效力、荧光颜色、胞内成像的信噪比等性质。团队总结发现,此类探针理性设计存在相关规律,主要体现在对二甲氨基苯基结构能够提高探针对于极性和黏度的敏感度,并且对于识别无定形蛋白聚集态至关重要;吸电子基团可以调控发射波长;探针分子的两亲性调控影响其胞内成像的信噪比。
基于上述研究,团队拓展了其他类型聚集诱导发光分子,并论证了上述规律的普适性。同时,利用优化后的探针,观察到在不同细胞压力刺激下,胞内蛋白质组所产生聚集态具有不同的形貌特征和位置分布。该研究系统阐释了无定形蛋白聚集态探针的理性设计方案,对未来该领域设计成像探针、质谱探针和药物分子提供了新的靶向策略和思路。(记者卜叶)
 全球观察:端午节期间日均132.1万人次出入境 较去年增长约2.3倍 据国家移民管理局25日消息,2023年端午节期间全国边检机关共查验出入境
全球观察:端午节期间日均132.1万人次出入境 较去年增长约2.3倍 据国家移民管理局25日消息,2023年端午节期间全国边检机关共查验出入境
 汽车博主发表贬损极狐汽车言论 极狐要求永久删除 近日,北汽极狐公司针对知名汽车博主袁启聪在抖音和微博发布的涉及极狐
汽车博主发表贬损极狐汽车言论 极狐要求永久删除 近日,北汽极狐公司针对知名汽车博主袁启聪在抖音和微博发布的涉及极狐  天天视点!极限 极限有高有低……心理极限极高的人可能身体会先到极限而出问题。身体极
天天视点!极限 极限有高有低……心理极限极高的人可能身体会先到极限而出问题。身体极  世界热推荐:观众齐喊“开空调”!梁静茹沈阳演唱会遭遇尴尬一幕 近期高温预警,再加上演出现场人员爆满,昨天是满场,估计昨天观看演唱
世界热推荐:观众齐喊“开空调”!梁静茹沈阳演唱会遭遇尴尬一幕 近期高温预警,再加上演出现场人员爆满,昨天是满场,估计昨天观看演唱 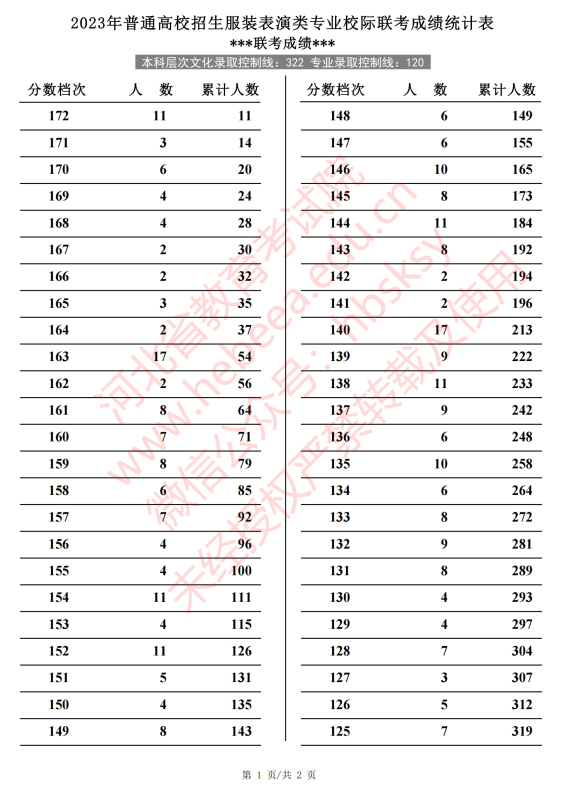 每日快看:2023年河北省普通高校招生服装表演类专业校际联考成绩统计表(专业成绩·综合成绩) 最新高考资讯、高考政策、考前准备、志愿填报、录取分数线等高考时间线
每日快看:2023年河北省普通高校招生服装表演类专业校际联考成绩统计表(专业成绩·综合成绩) 最新高考资讯、高考政策、考前准备、志愿填报、录取分数线等高考时间线  海口江东新区将建香港玉玲珑珠宝产业园 近日,记者从海口江东新区管理局获悉,位于海口江东新区离岸创新创业组
海口江东新区将建香港玉玲珑珠宝产业园 近日,记者从海口江东新区管理局获悉,位于海口江东新区离岸创新创业组